经颅电刺激系列之交叉短脉冲刺激 ISP
- 理财保险
- 2025-06-29
- 47454
传统经颅电刺激的困境与ISP 技术的诞生背景
经颅电刺激(Transcranial Electrical Stimulation, TES)作为一种非侵入性神经调控技术,在神经和精神疾病治疗中展现出潜力,但其临床应用长期受限于三大核心问题:
空间聚焦性不足:传统TES的电场在颅内呈扩散性分布,难以精准靶向特定脑区。
穿透深度有限:无法有效作用于深部脑区(如海马体),限制了其在癫痫、帕金森病等需要深部调控的疾病中的应用。
外周副作用显著:较高刺激强度易引发皮肤刺痛、灼伤感甚至前庭反应。传统TES的长时间持续电流会导致电荷在头皮累积,增加外周神经兴奋风险。
其他刺激技术,如HD-tDCS通过多电极阵列提升空间精度,但对深部结构(如海马、丘脑)的调控效果有限;TI刺激利用高频电流干涉产生低频电场,虽能穿透更深脑区,但依赖精确电极定位且高频成分易诱发外周神经刺激 。交叉短脉冲刺激(Intersectional Short-Pulse Stimulation, ISP)正是在这一背景下诞生的革新性技术,其核心在于利用神经元膜的时间积分特性,实现电场的非矢量整合,从而突破传统TES的物理限制。
HUIYING
ISP的技术原理与核心优势
非矢量整合机制
传统TES遵循麦克斯韦电磁理论的叠加原理,即多个电流源的电场在细胞外空间以矢量方式叠加。例如,同时施加的双极电场会因方向相反导致部分抵消,限制聚焦效果。ISP则颠覆这一逻辑,通过顺序施加快速短脉冲(脉冲宽度100 µs,间隔5-50 µs),使神经元膜以标量方式整合电场效应。具体机制如下:
动态电场交替:ISP刺激通过多个独立电极对交替施加短脉冲(100 µs),电场方向和强度在时间上快速变化。
不同电源配置下经颅电刺激(TES)中电场分布的等效性
膜电容的累积效应:神经元膜具有电容特性,能够将短时间内交替的电场效应累加,形成稳定的跨膜电位变化。
大鼠在对称交叉短脉冲刺激(ISP)期间的体内跨膜电位记录
非线性响应:神经元对电场的响应具有非线性特征,ISP通过标量整合放大深部脑区的刺激效果,同时减少外周组织的干扰。
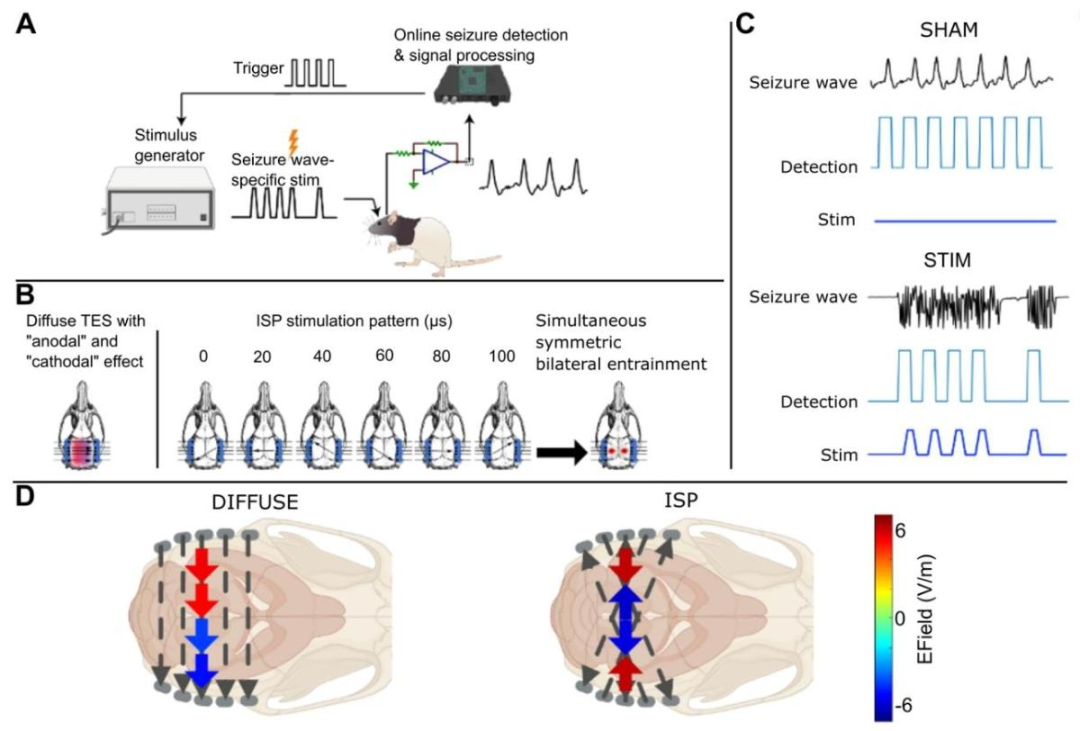
闭环干预和ISP刺激序列
这一机制使ISP能够克服传统TES的镜像效应,实现更均匀的深部脑区刺激。
技术设计要素:脉冲参数与空间聚焦
ISP通过以下设计实现精准调控:
多极旋转脉冲序列:使用3-6对电极,按顺序激活不同电极对,在颅内形成交叉电场路径。例如,在大鼠实验中,三对电极交替脉冲(每对脉冲2.5 µs)可在左右海马分别产生定向电场,避免传统双极刺激的对称扩散 。
ISP刺激电极位置与原理示意图
交叉短脉冲(ISP)刺激与乱序ISP刺激对人类受试者脑电图(EEG)影响的比较
短脉冲与电荷平衡:单个脉冲宽度10-100 µs,序列总电荷平衡(正负脉冲电量相等),既减少电荷累积引发的外周刺激,又确保膜电位的有效累积。
动态电场方向切换:通过快速切换电极极性,使目标区域神经元持续接受不同方向的电场刺激,增强局部整合效应,而外周组织因短脉冲的瞬时作用难以产生持续兴奋。

交叉短脉冲(ISP)刺激能够在空间上聚焦所诱导的电场
核心优势对比
特性 |
传统TES |
ISP |
电场叠加方式 |
矢量叠加,易抵消 |
标量整合,无抵消 |
空间聚焦性 |
扩散性,皮层为主 |
靶向深部结构(如海马、丘脑) |
穿透深度 |
<2 cm |
可达4 cm以上 |
外周副作用 |
显著(刺痛、灼伤感) |
低(短脉冲降低皮肤电荷累积) |
与记录兼容性 |
易干扰EEG /电生理信号 |
可同步记录(脉冲短且无直流偏移) |
HUIYING
ISP研究成果
计算模型与人体实验
为验证ISP的电场分布,研究者利用ROAST有限元模型模拟颅内电场,并在人类尸体中进行实测。结果显示:
模型与实测高度吻合:在94种刺激模式中,模拟与实测的电压梯度相关性达0.879,均方根误差(RMSE)仅0.6048 V/m,证实ROAST模型对ISP的适用性。
空间聚焦性量化:当电极对间距增大时,电场梯度预测精度提升;而邻近电极刺激因组织分流效应导致模型误差增加,提示电极布局对聚焦的重要性(文献1 -图2H)。
在大鼠模型中,ISP的电场聚焦性进一步得到验证:通过三对电极的旋转脉冲,可使同侧海马神经元放电率提升1.8倍,而对侧仅增加0.017倍,证实了半球特异性调控 。
神经元响应机制:从单细胞到网络层面
单细胞电生理证据:在大鼠体感皮层L2/3锥体神经元中,ISP诱导的跨膜电位变化与脉冲序列的标量和高度相关(R=0.98),而与矢量和相关性较低(R=0.71)。即使在弱电场(1 mV/mm)下,顺序脉冲仍能通过累积效应引发动作电位,而同时刺激需更高强度(3 mV/mm)才能达到相同效果。
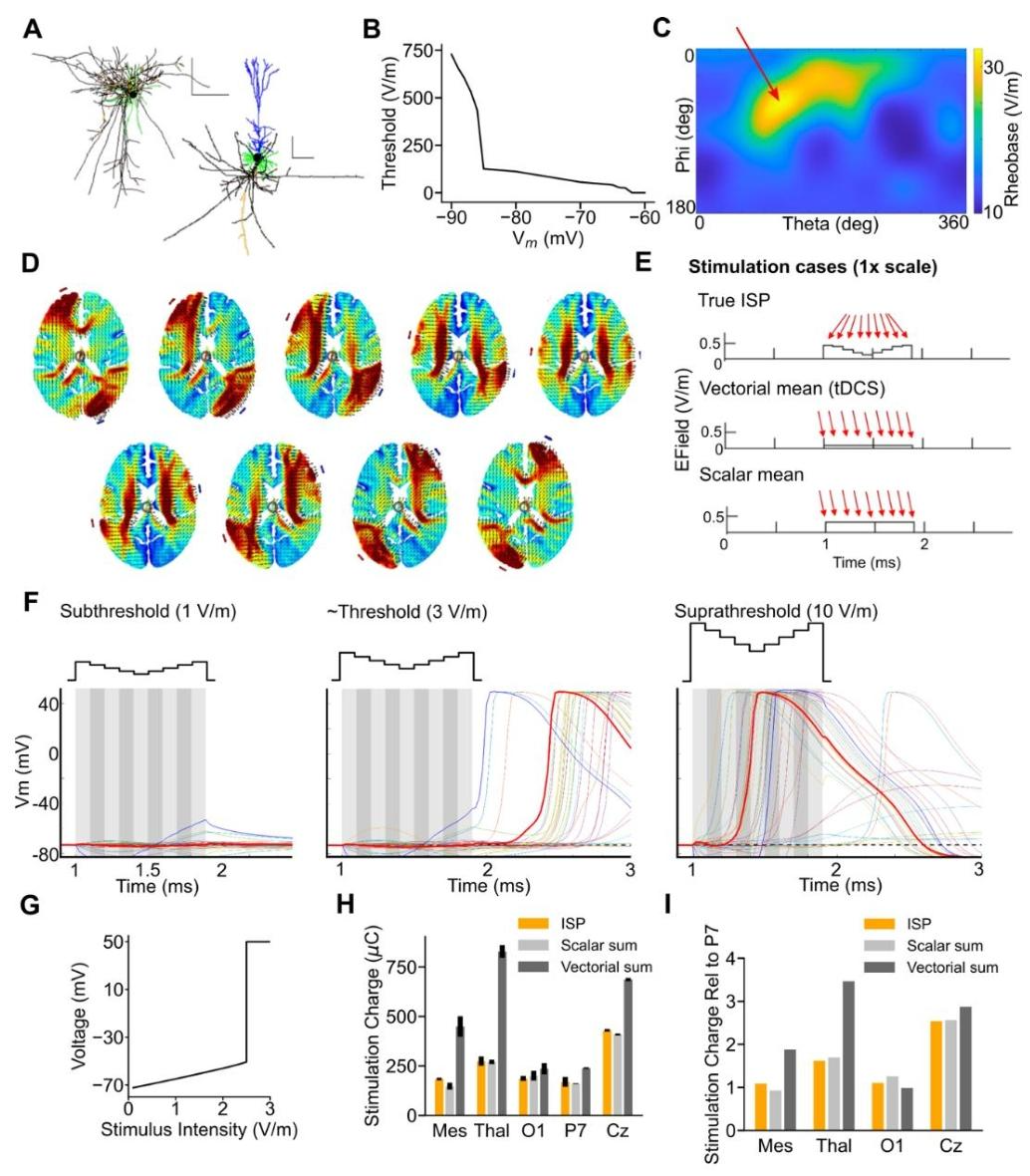
交叉短脉冲刺激(ISP)和弥散性经颅电刺激对人脑中单个神经元影响的模拟
网络水平调控:在颞叶癫痫(TLE)大鼠模型中,闭环ISP刺激可使海马seizure持续时间较假刺激减少49%,较传统TES减少41%,并将运动性发作严重程度(Racine评分)从4.88降至2.53。机制上,ISP通过破坏癫痫网络的同步性,阻断异常放电的扩散 。
人体实验:从安全性到脑网络调控
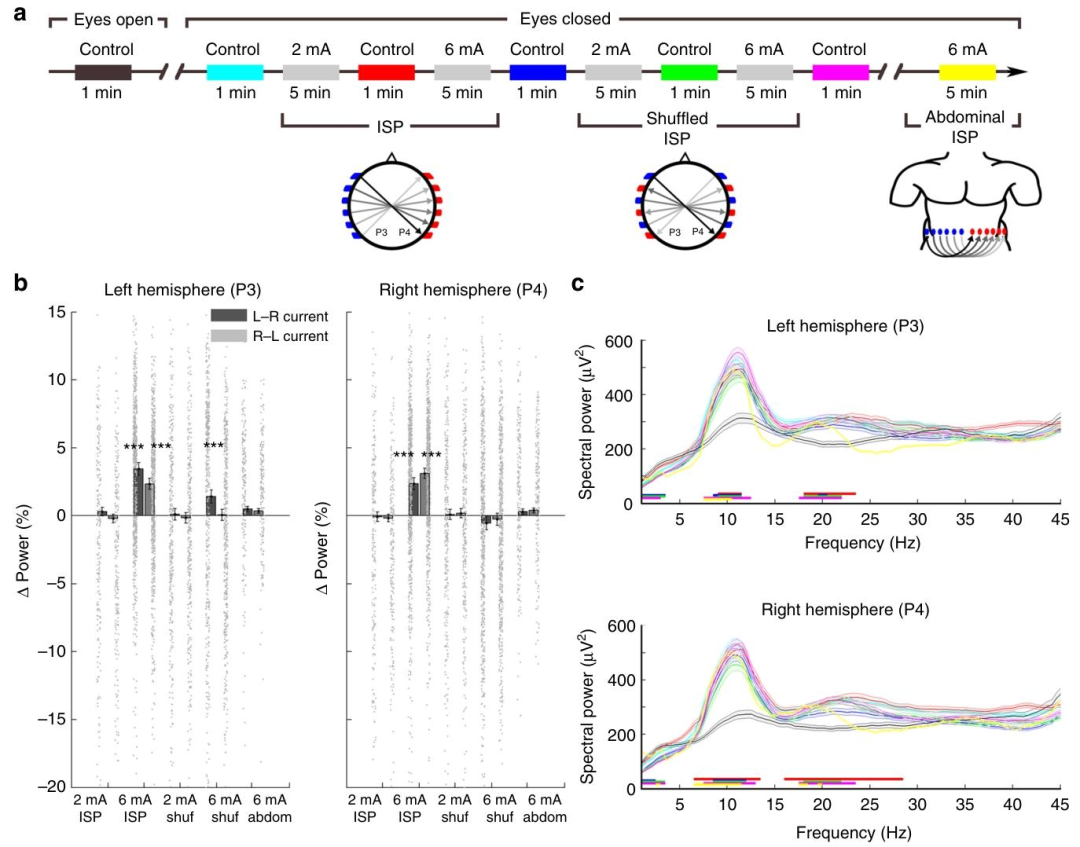
在19名健康受试者中,ISP展现出对人脑网络的直接影响:
alpha波相位调制:当施加4.5-7.5 mA的1 Hz正弦脉冲时,枕叶alpha波振幅随刺激相位呈现周期性变化。阳极同侧半球的alpha波在脉冲峰值时增强,阴极对侧则减弱,表明ISP可同步调制神经元群体的膜电位 。
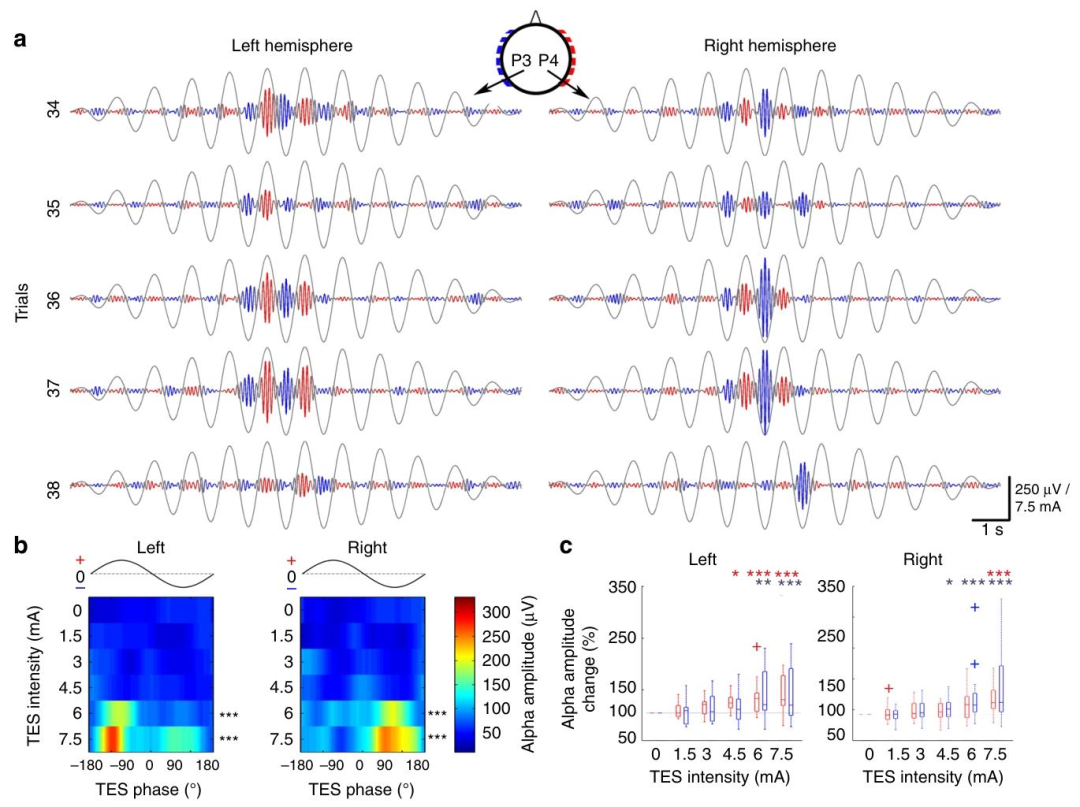
对人类受试者头皮进行的交叉短脉冲(ISP)刺激以相位方式调节其正在进行的α脑振荡
安全性特征:尽管4.5 mA以上刺激可引发轻微刺痛、金属味觉等主观感受,但无严重副作用,且效应随刺激结束迅速消失。通过优化电极布局(如32电极阵列),可进一步降低局部电流密度,提升耐受性 。
HUIYING
ISP的应用领域
癫痫治疗
与传统迷走神经刺激(VNS)相比,ISP具有更高的空间靶向性,可直接作用于癫痫灶(如海马),减少对正常脑区的干扰 。
神经精神疾病:靶向深部边缘系统
抑郁症:ISP可穿透至前额叶皮层下结构(如腹侧被盖区),调节多巴胺能神经元活动。在动物模型中,深部电场对奖赏回路的调控已被证实可改善抑郁样行为。
帕金森病:通过靶向丘脑底核或苍白球,ISP有望调节异常运动网络的振荡,缓解震颤和运动迟滞。其非侵入性优势可避免深部脑刺激(DBS)的手术风险。
神经科学研究:解析脑网络动态
ISP的高时空精度使其成为研究脑网络连接的理想工具。例如,通过聚焦于特定脑区(如默认模式网络节点),可实时解析其与其他区域的功能连接变化,为神经环路研究提供新手段 。
总结
ISP通过颠覆传统TES的电场叠加原理,利用神经元膜的生物物理特性,实现了非侵入性深部脑调控的突破。其核心价值在于将 “扩散性电场” 转化为 “靶向性电荷积分”,为癫痫、抑郁症等难治性疾病提供了全新治疗范式。随着计算模型的优化和人体实验的深入,ISP有望成为继DBS之后的又一革命性神经技术,开启非侵入性精准神经调控的新时代。
HUIYING
回映产品
1.交叉脉冲电刺激(ISP)设备(只做ODM或者联合开发)
核心工作机理:ISP(Intersectional Short-Pulse Stimulation,交叉短脉冲刺激)是一种基于非矢量电场整合的新型经颅电刺激技术,通过动态交替短脉冲序列精准调控目标脑区,突破传统TES(经颅电刺激)的空间扩散与深度限制。
其核心机理包括:
A.时序电场整合:采用多电极对(3-6对)交替释放超短脉冲( µs级),利用神经元膜的电容特性累积跨膜电位,实现深部脑区的标量叠加效应,避免传统TES的电场抵消问题。
B.动态路径聚焦:通过快速切换电极对的激活顺序(如旋转脉冲序列),在目标脑区(如海马、丘脑)形成交叉电场,增强局部刺激强度,同时减少外周组织(如皮肤、肌肉)的电荷累积。
C.非线性神经响应:短脉冲(10-100 µs)结合电荷平衡设计,优先激活高阈值深部神经元,而低阈值外周神经因脉冲间隔(5-50 µs)过短无法有效整合,从而降低副作用
关键参数
参数类别典型值/范围作用说明
脉冲宽度:10-100 µs 短脉冲减少皮肤刺痛,同时确保神经元膜的有效积分。
脉冲间隔:5-50 µs 短于外周神经整合时间(>200 µs),避免肌肉或皮肤兴奋。
电流强度:1-7.5 mA(人体安全阈值内) 深部刺激需更高电流(如4.5 mA以上),但通过多电极分流降低局部电流密度。
电极配置:3-6对高导电极阵列 优化空间聚焦性,例如32电极布局可提升深部靶向精度(误差<0.6 V/m)。
适应症
A.癫痫
靶向治疗:精准作用于癫痫灶(如颞叶海马),闭环刺激可减少49%的发作时长(动物模型),优于传统TES(41%)和VNS(迷走神经刺激)。
机制:破坏异常放电同步性,降低Racine评分(从4.88降至2.53)。
B.神经精神疾病
抑郁症:调控前额叶-腹侧被盖区多巴胺环路,改善奖赏功能(动物实验验证)。
帕金森病:非侵入性替代DBS(深部脑刺激),靶向丘脑底核,调节β振荡缓解震颤。
C.科研应用
脑网络解析:通过α波相位调制(如1 Hz正弦脉冲)研究默认模式网络动态连接。
神经可塑性研究:短脉冲序列可诱导长时程增强(LTP)或抑制(LTD),探索学习与记忆机制
2.便携式HD-tES
回映便携式高精度经颅电刺激仪(HD-tES)创新地采用type-C转生物电极的设计使得产品能够非常便捷地被使用。回映便携式高精度经颅电刺激仪(HD-tES)通过多电极配置(1个中心电极和4个返回电极)实现高精度电流聚焦,精准刺激目标脑区。其核心优势在于通过缩小电极尺寸(直径12mm的环形电极)和增加电极数量,显著提升刺激的聚焦性和精准性。
HD-otDCS 模式:叠加振荡电流于直流偏置,同步调节神经元兴奋性与节律性活动,高密度电极提升空间精度,频率特异性与个体化参数优化共振效应。
HD-tDCS模式:调节皮层兴奋性,适用于中风康复、抑郁症干预等。
HD-tACS模式:精准锁定脑电频段(如β-γ频段改善强迫症,4Hz增强工作记忆)适配认知障碍治疗等。
HD-tRNS模式:HD-tRNS 对显式和隐式计时任务的影响不同,用于研究大脑的计时机制和时间处理能力等。
调幅经颅交流电刺激模式(Amplitude-Modulated Transcranial Alternating Current Stimulation):通过载波频率(Carrier Frequency)与调幅频率(AM Frequency)的协同作用,实现对目标脑区特定低频神经振荡(如Delta、Theta、Alpha波)的节律性夹带(Entrainment),并精准调控跨频耦合(Cross-Frequency Coupling, CFC)机制(如Theta-Gamma相位-振幅耦合),以优化神经网络的同步性与功能连接。
适用范围:神经系统疾病治疗,意识障碍和认知功能调节,康复治疗,运动和认知功能恢复。认知增强、工作记忆优化及精神分裂症、抑郁症等神经精神疾病的网络同步性调节。

回映便携式HD-TES设备示意图

回映自研type-C转生物电极示意图
基本参数
刺激强度:-2mA~2mA 连续可调,调节分辨率0.01mA,输出电流误差 <=±10%;
刺激时间:0~60min 可调;
刺激频率:针对于 tPCS/tACS 模式,1Hz ~ 99Hz范围内可调,频率步进1Hz, 输出频率误差<=±5%;
淡入淡出时间:0~120s 可调,确保刺激的安全性;
脱落检测:通过实时阻抗检测分析电极脱落状态确保刺激有效性;
相位同步:<=±2.5us; <=0.09°;
2.手持式tES
经颅电刺激调控设备采用低强度的电流(±2mA以内)对大脑皮层的靶区域进行刺激,进而达到调节大脑皮层神经元兴奋性、调节脑电波节律、促进神经重塑和修复、改善脑部供血等。
震荡经颅直流电刺激(otDCS):改善认知功能、增强联想记忆,逆转轻度认知障碍患者的情景记忆衰退等
经颅直流电刺激(tDCS):治疗精神分裂症、抑郁症、物质成瘾、阿尔茨海默病、脑卒中后的运动功能障碍、语言障碍、认知障碍等
经颅交流电刺激(tACS ):治疗视功能障碍、认知障碍,提高学习能力、工作记忆等
经颅脉冲电刺激(tPCS):增强运动技能,缓解疲劳,促进知觉学习任务、算术任务,调节注意力切换任务的准确性,改善帕金森病患者的步态平衡等
经颅随机噪声刺激(tRNS):治疗耳鸣,提高工作记忆、认知能力等
调幅经颅交流电刺激模式(Amplitude-Modulated Transcranial Alternating Current Stimulation):通过载波频率(Carrier Frequency)与调幅频率(AM Frequency)的协同作用,实现对目标脑区特定低频神经振荡(如Delta、Theta、Alpha波)的节律性夹带(Entrainment),并精准调控跨频耦合(Cross-Frequency Coupling, CFC)机制(如Theta-Gamma相位-振幅耦合),以优化神经网络的同步性与功能连接。
适应症:焦虑、抑郁、失眠、癫痫、强迫症、注意缺陷多动障碍、巩固记忆、运动控制等。认知增强、工作记忆优化及精神分裂症、抑郁症等神经精神疾病的网络同步性调节。

回映便携式tES设备示意图
基本参数
刺激强度:10mA~30mA 连续可调,调节分辨率0.01mA,输出电流误差<=±10%
刺激频率:1Hz~99Hz 范围内可调,频率步进为 1Hz,输出频率误差 <=±5%
载波频率:2KHz~100KHz 范围内可调,频率步进为 1KHz,输出频率误差 <=±1%
刺激时间:0~60min可调
淡入淡出时间:0~120s 可调,确保刺激的安全性
脱落检测:通过实时阻抗检测分析电极脱落状态确保刺激有效性